在基础研究和临床应用中,荧光技术是一种改善生物医学检测和引导精准手术的成像方式。与X射线计算机断层扫描(CT)、核磁共振成像(NMRI)和正电子发射断层扫描(PET)等传统成像方式相比,荧光成像具有高时空分辨率、实时检测、无创和低成本等优点。其中近红外荧光成像,尤其是近红外第二窗口(NIR-II)的成像穿透深度更深,能显著降低生物组织的自身荧光,具有更高的信噪比,更适合在活体深层组织成像。荧光成像探针的构建是荧光成像技术发展中不可或缺的热点研究内容。对于活体荧光成像探针,除了波长、亮度、稳定性之外,探针在活体中的生物代谢以及特异性靶向性能等也扮演了重要角色。
目前所报道的活体荧光成像探针在注射入体内后,绝大部分都被肝、脾等网状内皮系统(RES)快速捕获,造成了探针的非特异性积累。近年来,调控探针的理化性质,改变其生物代谢路径,以此降低探针在RES器官中的非特异性富集、提高特异性递送效率,来实现高效特异性靶向诊断及治疗备受研究人员的关注。近日,研究团队在探针的生物代谢途径调控与特异性靶向荧光成像领域取得了新进展。
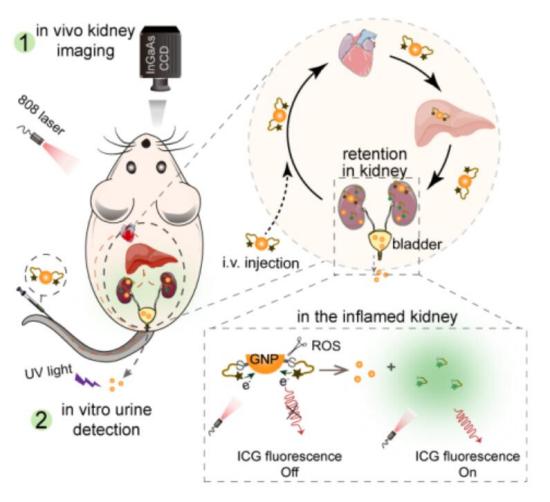
图1. 多肽介导的荧光探针用于肾脏的NIR-II成像示意图
在这篇工作中,作者发现:在有机荧光小分子如ICG分子上修饰一条亲水性多肽,能够显著改变ICG分子的生物代谢途径,由原本的快速被RES器官捕获并通过肝胆代谢转变为高效肾脏富集及缓慢肾代谢,从而实现分子在肾脏中的长时间靶向成像。作者设计了一系列多肽,通过系统比较多种不同多肽的理化性质,发现极性大的多肽(KTP)能够改变荧光探针的代谢途径,且肾靶向效率和在肾脏的聚集时间与多肽的极性成正比。将多肽偶联到本团队此前报导的多种NIR-II分子探针上(CX2,FD1080,LZ1105),均有相同效果。此外,这种多肽调控探针代谢途径不仅适用于上述有机小分子染料,也同样适用于超小无机纳米颗粒。可被肾脏快速清除的超小无机纳米颗粒(< 5 nm)表面连接上这条极性大的多肽,能显著延长纳米颗粒在肾脏中的停留时间。作者通过进一步研究证明,偶联多肽的小分子与纳米颗粒能够被肾小管细胞重吸收,因此实现长期的高效肾靶向成像。
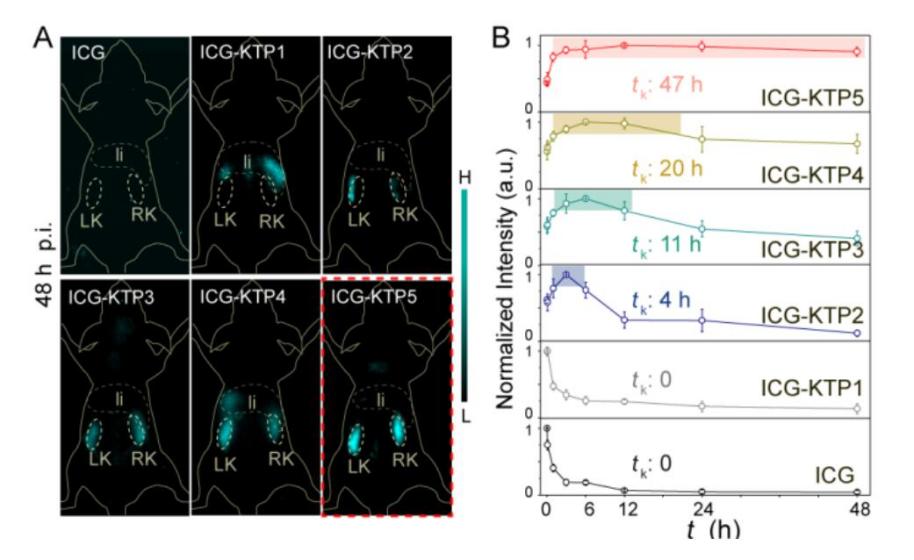
图2. 不同极性多肽修饰的荧光探针在肾脏中的富集
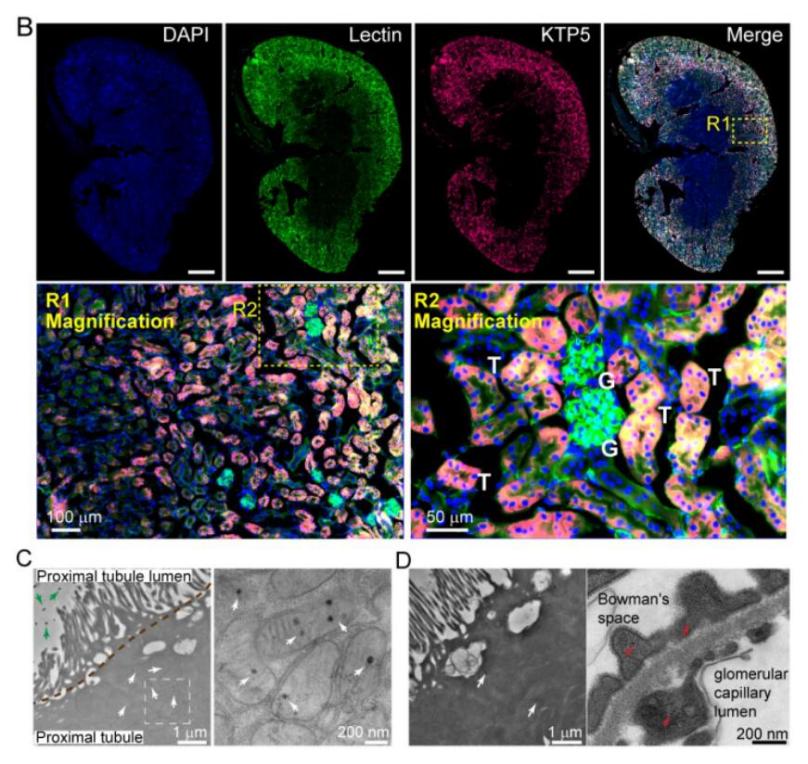
图3. 多肽修饰的荧光探针在肾小管中富集
基于上述发现,作者还设计了一种可被活性氧激活(ROS)的OFF-ON型肾靶向探针GNP-KTP-ICG,利用GNP对ICG荧光的猝灭和KTP的靶向作用,该探针能够高效富集到肾脏,并被肾损伤过程中产生的ROS激活,导致GNP与ICG-KTP的分离,从而ICG荧光恢复,可以实现NIR-II活体肾成像与体外尿液GNP荧光成像的双重成像模式,对早期肾损伤和肿瘤化疗药物导致的肾损伤进程具有良好的诊断功能。
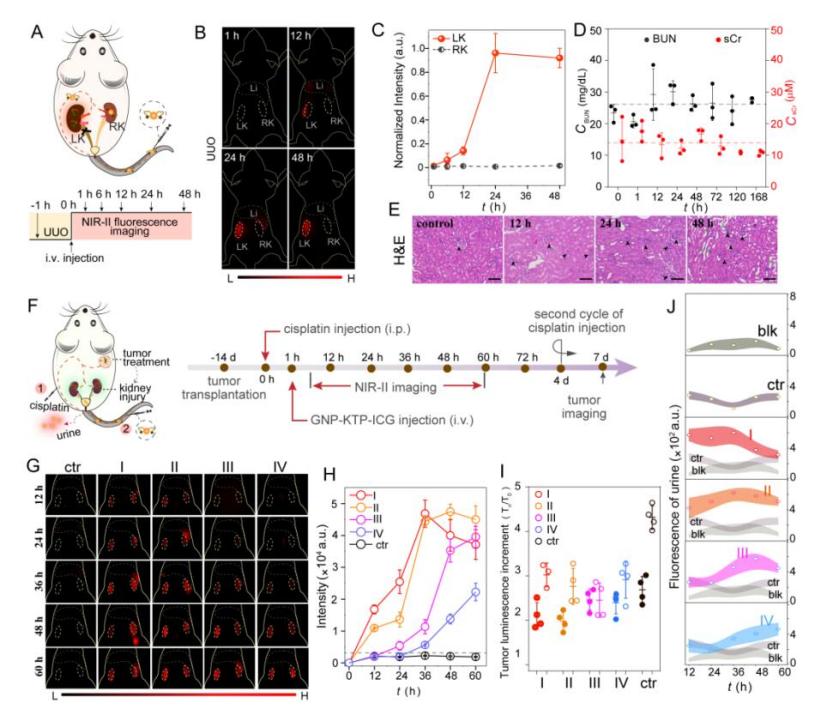
图4. 基于多肽的GNP-KTP-ICG荧光探针用于肾损伤检测
总结:在这项工作中,作者利用极性高的多肽调节探针在活体内的代谢途径,该方法广泛适用于不同的有机小分子及超小无机纳米颗粒,有望作为一种通用型肾靶向的生物分子平台,为肾疾病诊断与靶向肾脏给药提供了一种新的策略。
参考文献:
Ying Chen, Peng Pei, Zuhai Lei, Xin Zhang, Dongrui Yin, Fan Zhang*. A Promising NIR‐II Fluorescent Sensor for Peptide‐Mediated Long‐term Monitoring of Kidney Dysfunction. Angew. Chem. Int. Ed. , 2021, 60, 15809–15815.