近日,研究团队利用超分子组装实现近红外纳米探针在肿瘤部位的高效聚集,提高了病灶部位的成像信号。与此同时,团队通过近红外光调控实现在肝脏部位的可控解聚,有效降低了成像的背景信号以及颗粒沉积带来的潜在生物毒性。
纳米颗粒作为成像造影剂,可通过肿瘤部位的增强渗透与滞留效应(EPR效应)沉积在肿瘤部位。为了提高在肿瘤部位的富集,纳米颗粒的体内聚集被广泛应用于各种核磁成像、光声成像等成像手段。然而,大部分纳米颗粒在生物体内会被网状内皮系统,例如肝脏所捕获,并发生非特异性的聚集,这会造成过高的背景信号和不可逆的长期生物毒性。因此,纳米颗粒在体内的可控解组装是亟待解决的一个问题。
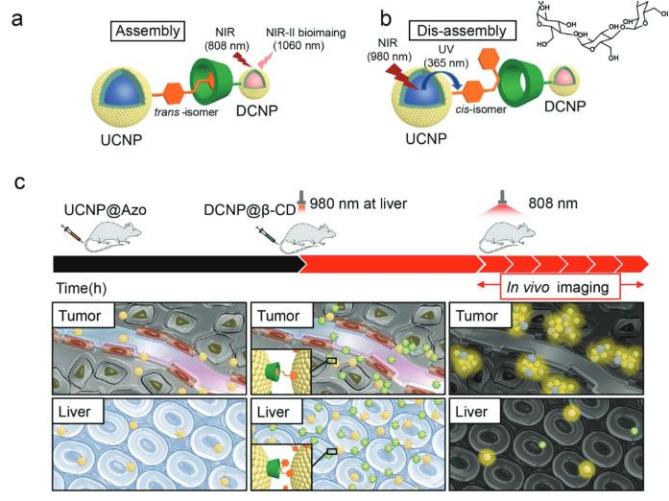
(a)纳米颗粒通过偶氮苯-环糊精超分子结构聚集示意图,下转换纳米颗粒发射的1060 nm光可用于近红外二区成像;
(b)980 nm近红外光介导的纳米颗粒解聚示意图;
(c)纳米颗粒肿瘤部位聚集及肝脏部位解聚示意图。
针对目前存在的问题,研究团队利用偶氮苯-环糊精的主客体超分子结构构筑了纳米颗粒体内的聚集体系,并利用穿透深度较深的近红外光(980 nm)激发上转换纳米颗粒,使其转换为可见光触发偶氮苯-环糊精之间的解离,实现纳米颗粒的体内解聚。同时,团队利用近红外第二窗口(NIR-II, 1000-1400 nm)稀土纳米探针(1060 nm发射)实现了动物活体的高效成像。该体内聚集-解聚体系可被广泛推广至其它成像及治疗领域。
参考文献:
Mengyao Zhao, Benhao Li, Peiyuan Wang, Lingfei Lu, Zhengcheng Zhang, Lu Liu, Shangfeng Wang, Dandan Li, Rui Wang, Fan Zhang*. Supramolecularly Engineered NIR-II and Upconversion Nanoparticles In-vivo Assembly and Dis-assembly to Improve Bioimaging. Adv. Mater., 2018, 30(52), 1804982.