免疫细胞治疗是一种革命性的癌症治疗方法,利用免疫细胞的力量选择性地靶向并消灭肿瘤细胞。然而,由于传统影像学方法需要每2-3周进行一次评估,该疗法的临床应用往往受到延迟治疗评估的限制。为了解决这一关键挑战,张凡团队最新的研究开发了一种非侵入性纳米传感器C8R-DSNP,旨在第二近红外长波段(NIR-II-L,1500-1900 nm)特异性实时监测免疫细胞活动。这一创新策略显著增强了深层组织成像能力,并加速了对治疗效果的评估(仅需4.5小时)。
新型纳米传感器用于快速检测免疫细胞-癌细胞相互作用
本研究团队首先合成了核/多壳结构的立方相铒掺杂下转换纳米粒子,实现了在808 nm和980 nm处的双激发,并且可以同时发出1532 nm的NIR-II-L荧光。之后通过在DSNPs表面修饰caspase-8(该酶在NK-92细胞与肿瘤细胞相互作用过程中被激活,是关键的外源性凋亡启动标志物)的特异性底物以及吲哚菁绿(ICG),成功制备了可特异性识别caspase-8的新型NIR-II-L比率型纳米传感器(C8R-DSNP),用于实时监测NK细胞介导的免疫治疗。由于吸收竞争诱导发射效应,ICG以及可作为808 nm激发的滤光层,大幅淬灭C8R-DSNP的1532 nm荧光(99%),而980 nm激发下的荧光信号基本不受影响。这一设计使C8R-DSNP在caspase-8酶切后能迅速恢复808 nm激发荧光,实现对免疫细胞介导的肿瘤细胞凋亡的高灵敏度检测。通过比率式NIR-II-L荧光成像,我们成功捕捉到NK-92细胞在小鼠模型中与肿瘤细胞动态相互作用的实时情况。成像结果显示,在NK-92细胞注射后短短4.5小时内,肿瘤细胞已开始发生凋亡——相比传统评估方法,大大缩短了免疫细胞治疗的评估时间。除了体内成像外,我们还通过体外尿液成像验证了凋亡过程的启动,检测到了被切割的荧光分子,提供了一种替代性的非侵入性疗法监测方法。
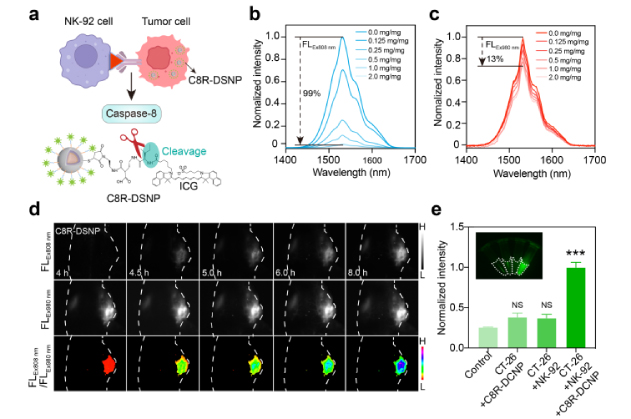
图1:(a)C8R-DSNP的比率荧光检测机制;
(b)连接不同浓度 ICG-NHS 后C8R-DSNP 在FLEx808 nm 和(c)FLEx980 nm 的NIR-II-L荧光强度;
(d)不同时间点小鼠在 980 nm和 808 nm激发下的NIR-II-L 比率荧光图像;
(e)不同组尿液中 ICG片段的荧光强度及其统计分析。统计值以平均值 ± s.e.m 表示;NS 表示无显著性,***P < 0.001(n = 3)。
实时追踪免疫单细胞在肿瘤微环境中的动态变化
此外,免疫细胞治疗过程中,了解NK细胞如何在肿瘤微环境中迁移并发挥作用,对于优化治疗策略至关重要。因此,研究团队利用 C8R-DSNP 标记 NK-92 细胞,并将其回输至肿瘤小鼠体内,连续8小时对血管内和肿瘤组织中的NK细胞进行单细胞追踪。并且,高时空分辨率的NIR-II-L显微成像揭示了NK-92细胞在从肿瘤边缘的外围血管逐步迁移至肿瘤实质的过程:在肿瘤实质中,NK-92 细胞以 51.5 μm/s ~ 0.0 μm/s低速爬行,进入血管后速度增至 238 μm/s。这对了解NK细胞在肿瘤微环境中的动态迁移模式提供了新的依据。
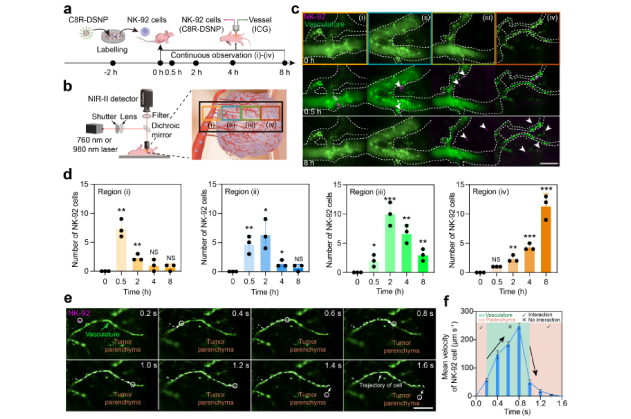
图 2. (a)NK-92 细胞在肿瘤组织血管中的时间轴成像。
(b)NK-92 细胞在肿瘤部位的实时NIR-II-L 显微成像示意图。
(c)不同区域和时间点 NK-92 细胞(紫色)在肿瘤血管(绿色)中的相应多重 NIR-II-L 图像。白色箭头指向外渗的 NK-92 细胞。
(d)不同时间下在i-iv区域分别收采集到的的 NK-92 细胞的数量统计。
(e)单个 NK-92 细胞(紫色)从肿瘤血管(绿色)到实质组织的轨迹追踪(白色虚线)。
(f)对(e)中 NK-92 细胞从血管浸润到肿瘤实质的平均速度的统计分析。
统计值以平均值 ± s.e.m. 表示;NS 表示无显著性,*P < 0.05,**P < 0.01,***P < 0.001(n = 3)。
参考文献:
L. Huang, J. Ming, Z. Wang, J. Wu, B.Yun, A. Liang, Y. Fan, F. Zhang, Noninvasively Real-time Monitoring In-vivo Immune Cell and Tumor Cell Interaction by NIR-II Nanosensor. Adv. Mater. 2025, 2420329. http://doi.org/10.1002/adma.202420329