由于具有无创、实时、高灵敏度和检测信号改善等多种优势,比率型纳米荧光探针在生物体内动态检测中得到了广泛的应用。然而,在体内研究中,比率传感的可靠性受到越来越多的关注。发射波长较短(<700 nm)的比率纳米探针在组织中容易受到光散射和自荧光干扰,叠加在光谱上导致体内传感准确度降低。由于具有降低的光散射和组织自发荧光,近红外二区(NIR-II)荧光探针广泛用于活体深层组织的传感。最近的一些研究基于发射波长接近的荧光团具有类似的光-物质相互作用的光谱比率或频率滤波等光学方法优化了NIR-II纳米比率探针在体内传感中的可靠性。然而,在生物介质中,由于探针的环境敏感特性及其与血清蛋白的强非特异性相互作用,NIR-II比率型纳米荧光探针普遍存在难以通过光学方法优化的光谱偏移和失真等问题,这阻碍了其在体内各种生物过程研究时的可靠性。
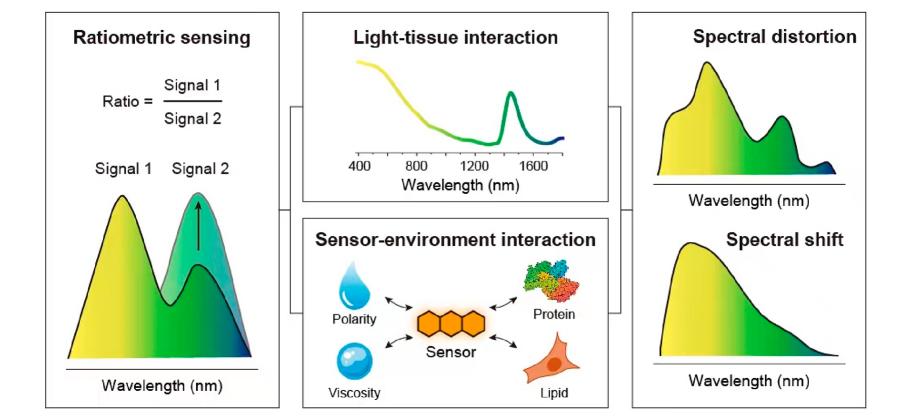
示意图. 光-组织和比率探针-环境的相互作用可使光谱畸变和移动,降低检测的可靠性。
鉴于此,团队创新性地开发了一种在胶束中掺杂共价连接的荧光分子二联体(Dyad)的策略,大大提高了NIR-II比率型纳米荧光探针的光谱保真度,用于可靠的体内生物检测。在血清溶液中,掺杂共价连接荧光分子的纳米探针的光谱保真度比掺杂非共价混合荧光团的纳米探针提高了9.4倍,对ONOO-的检测准确度提高了22.5倍。该比率型纳米探针可以用于评估创伤性脑损伤(TBI)后的体内氧化应激水平动态变化及脑损伤的治疗预后,且检测结果与金标准结果高度一致,表明其在体内高保真检测中具有重要应用潜力。
考虑到在NIR-II窗口具有较大的斯托克斯(Stokes)位移的荧光团可以尽可能多的过滤组织自身荧光,作者首先合成了一个Stokes位移有145 nm、最大发射为995 nm、化学稳定性高的非对称氮杂Bodipy (aBOP)作为FRET供体;另外,发射波长接近的两个荧光团具有相似组织衰减系数,通过对其发射光谱的两个区域进行比值可以获得更可靠的比率结果。基于此,作者设计了光谱匹配的菁染料(IR1110)作为FRET受体,并进一步在中位引入了提供电子的噻吩基团,使其对ROS具有高敏感性。得到的IR1110对ONOO-有特异性的快速荧光ON-OFF响应,其机制可能是IR1110被ONOO-单电子氧化,然后在C1/C1'位置裂解。作者设想aBOP和IR1110之间的FRET相互作用可以用于炎症疾病中ONOO-信号的比率传感评估。然而,aBOP和IR1110的荧光光谱能否在血液等生物介质中保持稳定影响了检测的可靠性。首先,作者测试了染料的环境敏感性,结果显示aBOP和IR1110的光谱都是溶剂敏感的。为了模拟探针-血液相互作用,作者将aBOP和IR1110分别封装到DSPE-PEG2000聚合物胶束中,然后与胎牛血清(FBS)溶液共孵育。随着孵育时间的增加,aBOP胶束显示出发射强度衰减和发射波长蓝移,而IR1110胶束相对稳定。尽管如此,供体aBOP的光谱不稳定性可以传递给受体IR1110,导致掺杂非共价混合荧光团的纳米探针的光谱失真。通过比较aBOP和IR1110的分子量、疏水表面积和LogP,发现这些值与染料在FBS溶液中的光谱保真度呈正相关。因此,作者合理推测具有大分子量、强疏水性的分子倾向于被锁定在胶束内部,进而可以获得一个受保护的稳定光谱。为了增加探针的分子量、疏水表面积和LogP,作者采用了分子二联体(Dyad)设计策略,通过共价连接氨基修饰的供体和羧基修饰的受体构建了分子探针aBOP-IR1110。由于分子量(1710 Da)、疏水性(LogP=12.36)的增加,在与FBS溶液共孵育12 h后,包裹在聚乙二醇胶束中的同浓度的aBOP-IR1110纳米探针比掺杂非共价混合荧光团的纳米探针(aBOP/IR1110)的光谱保真度 提高了至少9.4倍,表明掺杂Dyad分子的纳米探针具有高保真传感的潜力。
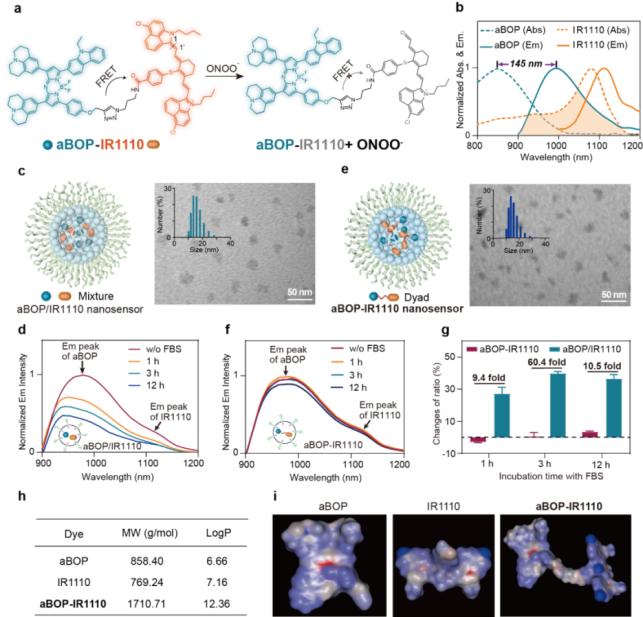
图1. aBOP-IR1110纳米探针的设计、制备及其在血清中光谱稳定性表征
随后作者对该纳米探针的检测能力和可靠性进行了评估。与ONOO- (0-16当量)反应后,该探针在950-1200 nm (F950LP)和1100-1200 nm(F1100LP)范围内的荧光强度比(F950LP/F1100LP)随着ONOO-浓度的增加呈线性增强,所有反应在35s内完成,具有实时检测的能力。重要的是,在相同条件下,与ONOO-反应后,相比于掺杂非共价aBOP/IR1110的纳米探针,掺杂共价aBOP-IR1110的纳米探针在FBS溶液中显示出22.5倍和2.3倍的比率光谱保真度,表明该纳米探针具有可靠地检测ONOO-的能力。这可归因于aBOP-IR1110与ONOO-的反应产物也具有较大的分子量(1483 Da)和较高的疏水性(LogP=7.87)。另外,该探针可以特异性的检测细胞内源性上调生成的ONOO-,并能对不同炎症程度的细胞中生成的ONOO-水平进行区分,表明该探针具有在活体内高保真地检测炎症的潜力。

图2. aBOP-IR1110纳米探针在体外检测ONOO-中的表征
由于ONOO-水平通常与创伤性脑损伤(TBI)的疾病进程及药物治疗效果密切相关,于是作者研究了aBOP-IR1110纳米探针在TBI小鼠模型中的检测能力。TBI后不同时间的氧化应激水平不同,该纳米探针在损伤不同时间(0-14天)后的TBI小鼠脑组织中出显著差异的比率信号强度,且比率荧光检测结果与脑梗死染色、脑组织H&E染色及血液免疫细胞浸润分析结果高度一致,表明该探针能够可靠地用于实时评估体内TBI的进程。
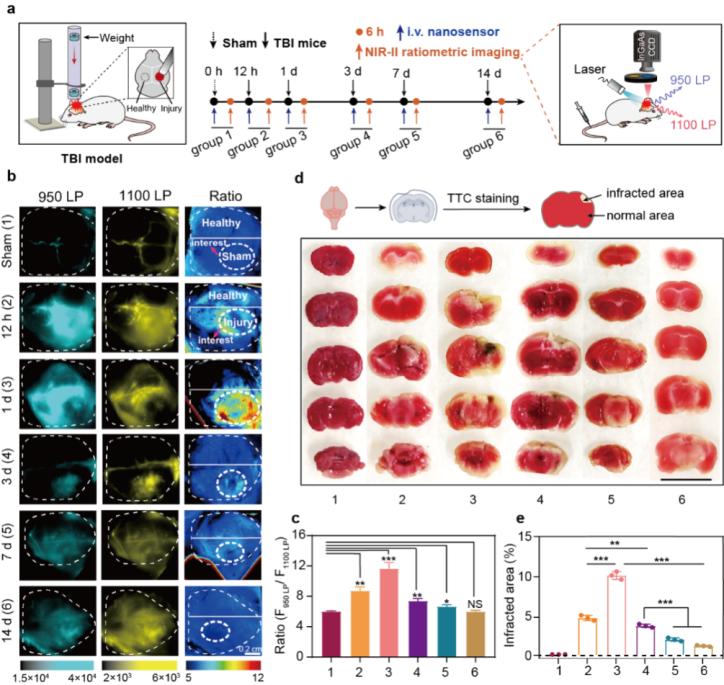
图3. aBOP-IR1110纳米探针用于监测脑损伤的疾病进程
接下来,作者评估了该纳米探针在用于评估TBI药物的治疗效果的可行性。由于损伤后氧化应激水平处于动态变化且不明确,药物靶点和治疗窗口难以准确评估,影响了药物效力降低和TBI的预后。基于此,作者检测了损伤后不同时间(0, 3, 12 h)注射抗氧化药物依达拉奉的TBI小鼠脑组织中的比率荧光信号强度。与12小时相比,损伤后0和3小时注射药物的TBI小鼠的比率荧光信号值显著降低,指示合适的治疗窗口为0-3小时。脑梗死染色、脑组织H&E染色及血液免疫细胞浸润分析结果进一步佐证了比率荧光检测结果,表明该纳米探针可以在体内及时可靠地评估TBI药物的治疗效果和合适的治疗窗口。

图4. aBOP-IR1110纳米探针用于评估脑损伤药物的治疗效果
团队通过在聚乙二醇胶束中引入NIR-II共价连接的二元分子探aBOP-IR1110,开发了一种可在体内应用的可靠的比率荧光纳米探针。增加的分子量、LogP和疏水性aBOP-IR1110纳米传感器在生物介质中具有高保真光谱,在特异性比率测定ONOO-方面表现出优异的检测准确度。结合长发射波长在组织穿透方面的优势,该纳米探针在体内实时评估TBI进展和治疗窗口具有较强的可行性和可靠性。因此,这种实时检测体系在未来指导新药开发、制定个性化的治疗方案方面具有很大的应用潜力,这种化学设计策略还可以扩展到制备各种NIR-II纳米探针,以可靠地检测体内其他生物标志物。
参考文献:
Peng Yu, Kui Yan, Shangfeng Wang,* Chenzhi Yao, Zuhai Lei, Yaohui Tang, and Fan Zhang*,NIR-II Dyad-Doped Ratiometric Nanosensor with Enhanced Spectral Fidelity in Biological Media for In Vivo Biosensing. Nano Lett., 2022, 22, 23, 9732-9740.