光学多重成像能够同时检测多个生化成分并直接观察不同的生理行为,这在生物技术和临床医学领域引起了广泛关注。近红外第二窗口(NIR-II,1000-1700 nm)下的荧光成像显著减少了光学散射而提供了较好的空间分辨率,它推动了非侵入式活体多重成像的发展。随着波长的延长,组织散射逐渐减少,水吸收是限制生物组织下光学穿透深度的关键因素。目前,仅NIR-IIb窗口(1500-1700 nm)的发光探针才能提供高分辨的活体荧光成像结果。然而,在这个狭窄的NIR-IIb区域中可用的探针数量十分有限,并且所用的荧光信号之间容易串扰重叠。因此,研究人员非常希望开发更多的发光探针来扩展优越的NIR-IIb成像窗口,增加高分辨活体多重成像中的可选通道。
为解决上述问题,复旦大学研究团队设计了一种新型的锂基质稀土纳米核壳结构。该颗粒掺杂有稀土铥离子(Tm)和铒离子(Er),使用1710 nm激光器能够激发核层的Tm并传递给壳层的Er离子发出特征荧光,荧光光谱显示其发射峰覆盖了可见光和近红外区。进一步,通过功率依赖关系曲线、拉曼散射光谱和变温荧光光谱的结果证明了这种发射机制需要声子辅助和激发态吸收两个过程参与,并且荧光发射强度受基质材料的影响较大。实验对比发现,Li基质的声子能比Na基质更高,因而Li基质下的发光强度更高。

图1. (a) 本工作开发的一种可被1710 nm激发产生反斯托克斯位移发光的新型稀土纳米晶;
(b) 新型纳米晶体在1710 nm激发下的发射光谱;
(c-e) 本工作最优结构的形貌、尺寸和元素等表征结果
本工作优化后的核壳结构颗粒具有优良的发射性能。皮下肿瘤模型的成像对比显示,所提出的Tm@Er@LiNCs颗粒(1710 nm激发,1532 nm发射)相比于之前最长的近红外二区反斯托克斯位移发光体系Er,Ho@Y(1532 nm激发,1180 nm发射),信噪比提升了12.7倍,这可能是由于激发光1710 nm比激发光1532 nm有更小的水吸收,使得成像信号强度更大。因而,本工作提出将这种具NIR-IIb区发射的反斯托克斯位移探针与之前报道的Er探针(Yb,Er,Ce@Y,激发:915 nm,发射:1532 nm)和Tm探针(α-Yb,Tm@Yb@Y,激发:915 nm,发射:1632 nm)等结合,进行三通道的活体多重成像。使用这三种发光纳米探针可以同时点亮血管网络、大小肠和结直肠等器官,并呈现了小鼠在清醒和麻醉状态下的肝脏富集材料速率和肠道蠕动速率,展现了活体多重成像在临床给药策略方面应用的潜力。
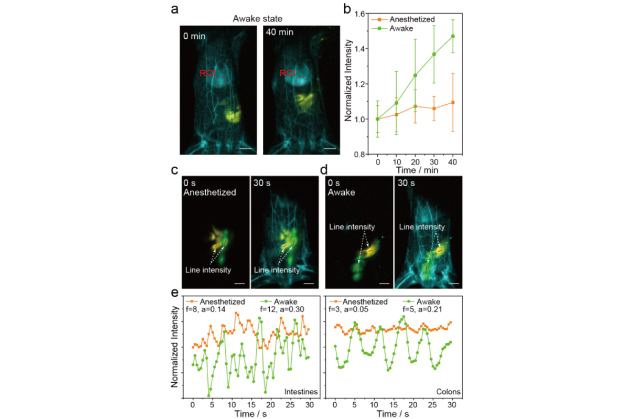
图2. (a-b) 使用本工作开发的探针可以呈现不同生理状态老鼠的肝脏富集的速率差异;
(c-e) 使用三种NIR-IIb的纳米探针对小鼠不同生理状态下的多重动态成像结果,提取出的荧光强度随时间变化反映了大肠和结直肠在清醒和麻醉状态下的蠕动差异。
总之,这是首次在NIR-IIb区内构建反斯托克斯位移发光和下转换发光结合的多重成像模式。本工作证明了这种反斯托克斯位移发光机制兼有声子辅助的能量转移和激发态吸收等过程,使得其能够发出涵盖可见到近红外区的发射。这种新型的反斯托克斯位移发光纳米探针拓展了活体多重成像的设计思路,也将激励广大研究人员深入了解调控镧系离子能级跃迁的方法。
参考文献:
Zi-Han Chen, Baofeng Yun, Yanran Hou, Xiaohan Wang, Xusheng Wang, Jing Xu, Li Jiang, Ting Han, Hongxin Zhang*, Fan Zhang*. NIR-II Anti-Stokes Luminescence Nanocrystals with 1710 nm Excitation for in vivo Bioimaging. Angew. Chem. Int. Ed., 2024, e202416893. DOI: 10.1002/anie. 202416893.